Кристаллическая решетка алмаза
Кремированное тело человека массой 80 кг превращается в 2,5 кг пепла. Некий Риналдо Уилли из Швейцарии, еще учась в университете, увлекся изучением вопроса превращения углерода в искусственный алмаз. Ему пришла необычная идея – превращать пепел умерших людей в алмазы. А как происходит образование в природе?
Содержание статьи
Способ образования
Алмаз – один из самых дорогих драгоценных камней уже много столетий. Вопросы о генезисе до недавнего времени были спорными. Ещё в 50-х годах прошлого столетия утверждалось об их растительном происхождении, причем монография Гепперта об этом была удостоена высших наград и признаний со стороны голландского ученого сообщества. Продолжалось такое положение дел совсем недолго, а именно, открытие воронок в Африке и метеоритов с алмазными вкраплениями изменило устоявшее суждения о происхождении этого камня.
Основной тип месторождений – трубки, образованные взрывом, их еще называют диатремы. Эти диатремы в основном сложены кимберлитами – брекчиевидными изверженными породами. Кимберлиты в своем составе содержат также и древние глубинные породы – ксенолиты. Существует предположение, что именно они слагают верхнюю мантию Земли.
Глубинные породы с алмазами, вынесенные взрывом на поверхность, а также минеральные включения, указывают образование последних под действием высокого давления и температуры. Эти два показателя говорят об определенной фации глубинности (110-135 км) при давлениях 4-4,3 Гпа. Если перевести в привычные «атмосферы» или «бары», то получится приблизительно 40 тыс. атмосфер. На сегодня считается, что алмаз в трубках образовался на глубине 100-200 км при температурах 1300-1700oC и более высоких давлениях.
Несмотря на условия образования, алмаз на земной поверхности – неустойчивая стабильная углеродная модификация. По нашим представлениям он должен был преобразоваться в графит, но этого не произошло.
Физические и химические свойства
Алмаз не является на 100% чистым углеродом, как и в других относительно чистых минералах присутствуют различные примеси. Главной примесью, оказывающей влияние на свойства камня, является азот. Кристаллы, которые непрозрачны к УФ излучению, относят к 1 типу, а все остальные – 2 тип. В 1 типе камней азотная составляющая достигает 0,25%, тогда как во втором азот не превышал 0,001%. На этом примере мы видим корреляцию различных свойств камня, что позволяет делать предварительные выводы внутреннем составе без детального изучения о принадлежности к типам.
Алмаз не вступает в реакцию с растворами кислот и щелочей и только при температуре 800 ºС довольно легко реагирует с расплавленными щелочами, солями кислородных кислот и некоторыми металлами.
Сгорает на воздухе при температуре 850-1200 ºС, выделяя углекислый газ. Окисление происходит при 600 ºС, а при нагревании до 1600 ºС в вакууме частично превращается в графит.
Алмаз – самый твердый минерал на Земле. По шкале Мооса – 10. При этом очень хрупкий. Твердость на различных гранях кристалла не одинакова, самая прочная – октаэдрическая грань. Плотность 3515 кг/м3 у прозрачных образцов, у непрозрачных немного ниже. Отталкивает воду, но прилипает к жирам. На свойствах основан метод отбора камней из руды, иногда применяемых в комплексе.
Строение кристалла
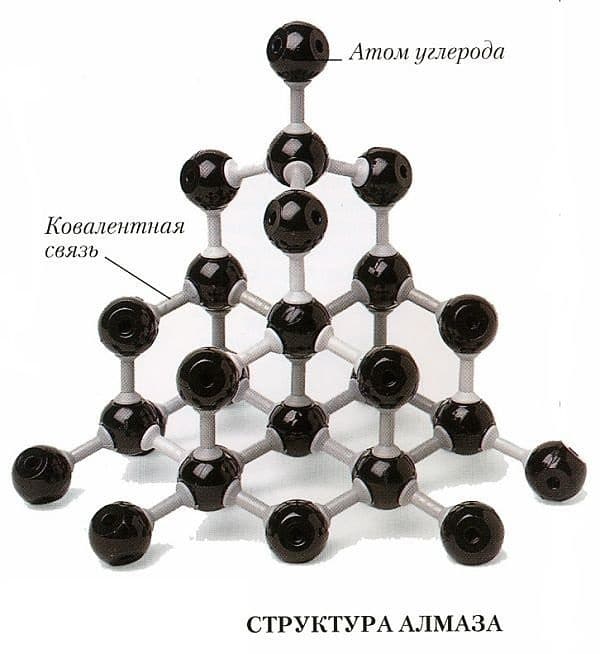 Для понимания строения сравним кристаллическую решетку алмаза с графитом, так как они имеют один и тот же химический состав, но резко отличаются по твердости. Это различие обусловлено связями атомов углерода в кристалле. В алмазе один атом углерода окружают 4 таких же атома (кубическая структура), создавая правильную 4-х угольную пирамиду. Эти связи между симметричными атомами очень прочны, что и создает такую прочность.
Для понимания строения сравним кристаллическую решетку алмаза с графитом, так как они имеют один и тот же химический состав, но резко отличаются по твердости. Это различие обусловлено связями атомов углерода в кристалле. В алмазе один атом углерода окружают 4 таких же атома (кубическая структура), создавая правильную 4-х угольную пирамиду. Эти связи между симметричными атомами очень прочны, что и создает такую прочность.
Графит же представлен слоистой структурой. Химические связи между атомами существуют внутри слоя и образ кристаллическая решетка алмазауют гексагональную сетку (гекса – кратно шести), связи же между слоями (межмолекулярные) слабые, слои как бы скользят относительно друг друга. На этом свойстве основаны графитовые смазки.
Тип кристаллической решетки алмаза
Вспоминая курс химии за 11 класс, мы знаем, что существуют 4 типа кристаллических решеток:
- атомная;
- металлическая;
- ионная;
- молекулярная.
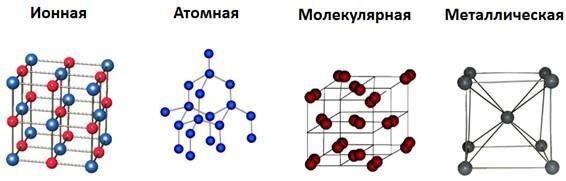 Не углубляясь в определения каждого, сразу отметим, что кристаллическая решетка у алмаза атомного типа, соединенные ковалентной связью. Кстати, за рентгеноструктурное исследование отец и сын Брэгги в 1915 году были удостоены Нобелевской премии.
Не углубляясь в определения каждого, сразу отметим, что кристаллическая решетка у алмаза атомного типа, соединенные ковалентной связью. Кстати, за рентгеноструктурное исследование отец и сын Брэгги в 1915 году были удостоены Нобелевской премии.
Химическая связь в углеродных минералах
По химическому составу алмаз – углерод в чистом виде, но из углерода состоят много других минералов, веществ на Земле, и они все совсем непохожи друг на друга. Давайте разберемся в модификациях и ответим на этот вопрос.
По мнению ученых углерод изначально содержался в газовом облаке, из которого образовывались планеты. В каждой планете присутствует этот элемент, более того, это один из 4 макроэлементов, являющийся «строительным материалом» нашего тела. Имея различные химические связи и расположения атомов относительно друг друга углерод составляет разные вещества. Это свойство называется аллотропией. Если условно назвать их модификациями углерода (аллотропными модификациями), то применительно к геологии, известны следующие:
- алмаз (самая дорогая форма);
- графит (получил широкое применение в промышленности);
- лонсдейлит (встречается в метеоритах);
- фуллерены (недавно открытые формы);
- графен;
- уголь;
- сажа.
Все эти вещества в основе своей имеют углерод, но как мы видим они отличаются друг от друга. Такое сочетание возможно благодаря химическим связям между атомами этого элемента и их расположению.
Для тех, кто заинтересовался этой темой, может быть полезен научный фильм, который легко разыскать на просторах интернета, а называется он «Углерод и его аллотропные формы – алмаз и графит» (Киевнаучфильм, 1981 год).
Применение в промышленности
Алмаз не царапается ни одним из существующих элементов на Земле. Это замечательное свойство получило широкое распространение в области народного хозяйства. Два аллотропных состояния одного химического элемента углерода – графит и алмаз, а имеют столь разное применение. Графит наименьшей твердостью используется в качестве сухой смазки в механизмах трения, тогда как алмаз с наивысшей твердостью по шкале Мооса, применяется в качестве абразивного материала. Буровые коронки с алмазным напылением, шлифовальные круги – это малая часть орудий производства по обработке материалов.
Алмаз нашел своё применение и в изучении космоса в качестве теплоотводящего материала при экстремальных температурах.
Cтанция «Пионер», запущенная к Венере в 1978 году, была покрыта материалом из алмазной крошки.
Широкое применение технических образцов (искусственно полученных) известно в радиоэлектронике, оптических приборах, при производстве медицинских инструментов. Для нужд техники производится 500 млн карат искусственных алмазов, это 100 тонн ежегодно.
Как получить драгоценный камень из графита
Для получения синтетических аналогов необходима высокая температура и давление в специальных установках. Конечно, давление, созданное геологическими преобразованиями, не сравнимо по длительности действия. Считалось, что драгоценные камни из графита получить практически невозможно из-за технических сложностей. Первые искусственные драгоценные камни были получены весом меньше одного карата (1 карат = 0,2 г) и даже были огранены, но получение более весомых экземпляров наталкивалось на определенные трудности. Дело в том, что сложные установки не в состоянии выдержать долгое время высокую температуру и давление, а для выращивания полукаратных образцов нужно время.
С развитием технического прогресса известны две распространенные технологии получения синтетических образцов: HPHT (high pressure high temperature) и CVD (chemical vapor deposition). Первый расшифровывается – «высокое давление высокая температура», а второй метод – «химическое парофазное осаждение».
Самый крупный по технологии HPHT получен в России (32,26 карата) и был огранен. Масса бриллианта составила 10,02 карата.
Позже в Китае был создан самый крупный искусственный аналог CVD в мире массой 46,2 карата (ограненный бриллиант – 12,75 карат). Оба экземпляра подтверждены сертификатом Международного Геммологического Института (IGI) в Гонконге.






